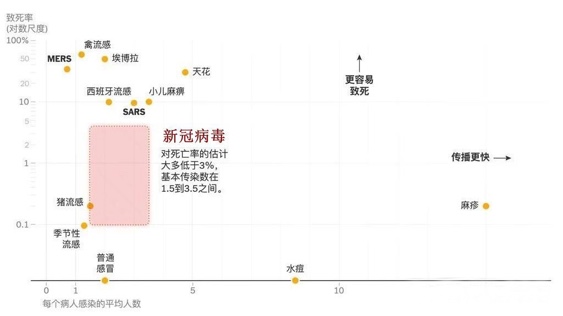
人类医学的发展史实际就是与病毒的斗争史。著名病毒对人类的影响远超其他的灾难,实际上很多王朝的更迭、战争的转折与终结背后都或多或少有着病毒的身影。2019年出现的COVID-19病毒凭借其优秀的传染能力势必在人类病毒史上留下重要一笔色彩。针对新冠,一方面尚未出现有效治疗药物,另一方面人类需要尽快解社交隔离、恢复正常生活,全球药企和科学家们都将注意力放在了疫苗研发上。
目前新冠疫苗研发路线主要分为五大类:灭活疫苗、减毒疫苗、重组蛋白疫苗、病毒载体疫苗和核酸疫苗。对比五项技术,核酸疫苗、重组蛋白疫苗和病毒载体疫苗这类新兴技术的研发速度相对较快,而灭活疫苗和减毒疫苗的工艺成熟度较高。

不同研发路线的疫苗其基本原理和作用是一致的,即利用抗原本身来制备生物制剂,通过接种到人体来激活免疫反应,从而使得人们在遇到真正的相同病原体时,可以及时地发现和消灭它们。按照不同的制备工艺,在 5 种方法里,减毒/灭活疫苗是直接用病毒做成疫苗刺激健康人体内的免疫系统,其他路径都是基于一个相同的理论基础:通过表达病毒上的 S 蛋白,引起人体针对新冠病毒产生的免疫保护机制。
下面重点来了,到底什么是mRNA疫苗,它的原理和特点是什么?
2020年11 月 16 日,Moderna 公司宣布,其新冠肺炎三期试验疫苗 mRNA-1273 初步试验数据有效性达 94.5%。两天后,美国辉瑞制药和德国 BioNTech 公司合作研发的 mRNA 新冠疫苗三期临床试验最终数据公布,其有效性达 95%,且在 65 岁以上成年人中的有效率为 94%以上。 2020 年 12 月 12 日,美国 FDA 发布了首个新冠疫苗的紧急使用授权(EUA),允许辉瑞 /BioNTech 的 mRNA 新冠疫苗在美国使用,用于 16 岁及以上个体预防新型冠状病毒引起的COVID-19。

相信大家对上面的新闻不会特别陌生,很多人一定很好奇,从小就打疫苗的大多数人在新冠之前可能从未听说过mRNA这项技术。
简单来说,当人体需要完成某一任务,如消灭某一类外来病毒时,需要在体内表达抗体蛋白质来抵抗。机体通过参阅病毒 DNA 基因 “说明书”,学习并以 RNA 的形式制作“笔记”,这一过程在生物学上称为“转录”(Transcription), RNA“笔记”经过修饰的“消化吸收”之后,变成可以指导蛋白质合成的“教科书”mRNA,在蛋白质加工厂“核糖体”中合成蛋白质以刺激机体产生特异性免疫学反应从而消灭病毒,合成蛋白质的过程在生物学上称为“翻译”(Translation)。mRNA 是连接基因和蛋白质的桥梁。
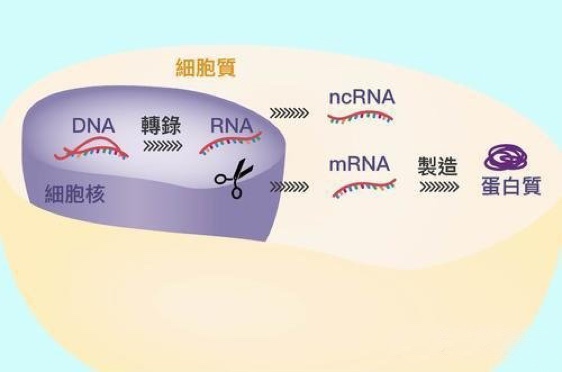
mRNA 疫苗利用抗原编码信使 RNA,通过特定的递送系统使细胞摄取并表达编码的抗原,从而引起体液和细胞介导免疫反应的疫苗。以辉瑞/BioTechde 的 mRNA 疫苗为例,该疫苗编码新冠病毒的刺突蛋白。当接种这种疫苗后,mRNA 会指导人们身体内的细胞产生刺突蛋白的拷贝,这些刺突蛋白冰不会引起疾病,但会出发免疫系统产生针对新冠病毒刺突蛋白的免疫反应。
mRNA 疫苗有两种类型,一种是可以自我扩增(self-amplifying 或者 replicon),另一种是非复制型(non-replicating)。前者的编码 RMA 复制机制的基因是完整的,用编码抗原蛋白的mRNA 代替了原病毒的结构蛋白编码基因,因此这类 RNA 疫苗能够在体内自我扩增,很少的量就可以引起较强的免疫反应。后者是在体外转录好的一段编码抗原蛋白的完整 mRNA,用多种修饰技术来修饰mRNA的稳定性,最后利用纳米脂质体等递送技术将mRNA递送至细胞内,从而翻译抗原蛋白,引发免疫反应。
与传统疫苗相比,mRNA 疫苗具备以下优势:1)抗原选择范围广;2)具备自我佐剂特点,表现更强的免疫原性;3)具备足够的安全性。与质粒 DNA 疫苗相比不进入细胞核内部,只在细胞质内表达抗原,不存在整合人体基因上的风险;4)存在多种修饰方法,能够使 mRNA 疫苗更加稳定,翻译效率更高,同时纳米脂质体递送方式的发展能够使 mRNA 疫苗快速递送到细胞内从而发挥功能。5)不依赖细胞培养技术,可快速构建疫苗。现在的体外转录技术能够非常快速、廉价地大规模生产 RNA 疫苗,相较于传统活疫苗 5-6 个月的生产周期,mRNA 疫苗只要有了病毒的基因序列,有望在 40 天内完成疫苗样品的生产制备。因此有望更好的应对突发的传染病疫情。6)生物化学合成,生产过程无病毒感染风险。
mRNA 疫苗开发需要解决的重点是解决递送技术,裸露的 RNA 很容易受到体内 RNA 切割酶的攻击,我们看到,无论是辉瑞还是 moderna,他们疫苗的运输都需要极其苛刻的条件。 mRNA 递送的体内行为高度依赖于所用的材料,即使用相同的材料,其和核酸复合/包封后形成的脂质纳米颗粒的粒径、结构特征、表面性质对体内行为均有重要的影响。

mRNA 疫苗递送载体可以分为病毒载体和非病毒载体。其中,病毒载体以慢病毒、腺相关病毒、仙台病毒等为主。病毒载体虽然可以进行核酸递送,但也可能会引起免疫反应,从而影响疫苗本身的效果。
非病毒载体主要包括脂质体、树突细胞(dendritic,DC)、无机纳米粒子、阳离子细胞穿膜肽等。其中,由于具有易与受体细胞融合、转染效率高、抵御核酸酶的作用、不受宿主限制等独特优势,脂质载体是目前实际应用中最常用的 mRNA 非病毒载体。纳米脂球(LNP)是目前唯一经过工业界验证的核酸递送技术。
目前辉瑞/BioNtech 和 Moderna 的新冠疫苗已获得多个国家的紧急批准。 尽管mRNA疫苗在多个国家都获批,但mRNA 疫苗的大规模接种本身会面临挑战。以辉瑞/BioNtech 的疫苗为例,该疫苗必须在-70℃以下的温度进行运输和储存。在标准冷藏温度(2—8℃)下,它最多只能存储 5 天。疫苗冷链体系,包括疫苗的储运和配送,具备一定的难度。此外,疫苗如需放量供应,需要有相应的灌装能力与之匹配,目前看来,仅在一个国家实现灌装存有一定的难度。 关于 mRNA 疫苗的后续技术难点将围绕以下几个方面展开:
1) 加强免疫的可能性
2) 剂量范围以及儿科中的研究
3) 妊娠期使用的研究
4) 有免疫缺陷人群中的研究
5) 第二代配方的冰箱稳定性
6) 和流感疫苗联合接种管理的研究








